Enlace iónico
Características:
- Esta formado por metal + no metal
- No forma moléculas verdaderas, existe como un agregado de aniones (iones negativos) y cationes (iones positivos).
- Los metales ceden electrones formando por cationes, los no metales aceptan electrones formando aniones.
Los compuestos formados pos enlaces iónicos tienen las siguientes características:
- Son sólidos a temperatura ambiente, ninguno es un liquido o un gas.
- Son buenos conductores del calor y la electricidad.
- Tienen altos puntos de fusion y ebullicion.
- Son solubles en solventes polares como el agua.
Enlace covalente
Características:
Sustancias covalentes moleculares: los enlaces covalentes forman moléculas. Tienen las siguientes propiedades:
- Temperaturas de fusión y ebullición bajas.
- En condiciones ordinales (25 °C aprox.) pueden ser sólidos, líquidos o gaseosos
- Son blandos en estado sólido.
- Aislantes de corriente eléctrica y calor.
- Solubilidad. Las moléculas polares son solubles en disolventes polares y las apolares son solubles en disolventes apolares (semejante disuelve a semejante).
Enlaces polares
Enlace covalente polar.- Los enlaces son polares debido a que los dos átomos tienen diferentes electronegatividades. La polaridad se debe a la distribución desigual de los electrones debida a que el átomo más electronegativo tiene una mayor atracción hacia el par compartido de electrones. Cuando se tiene un enlace covalente polar en una molécula diatónica, como el HCl, la molécula es polar. Por polar se entiende una distribución desigual de la carga eléctrica. En general, sin embargo, la molécula de HCl es neutra porque la carga negativa parcial del átomo de cloro esta compensada exactamente por la carga positiva parcial del átomo de hidrógeno.Enlace Covalente no polar.- Es cuando el par de electrones compartidos están igualmente atraído por los dos átomos. Se forman entre el mismo tipo de átomos.
Enlace metálico.
Un enlace metálico es un enlace químico que mantiene unidos los átomos (unión entre cationes y los electrones de valencia) de los metales entre sí. Estos átomos se agrupan de forma muy cercana unos a otros, lo que produce estructuras muy compactas. Se trata de redes tridimensionales que adquieren la estructura típica de empaquetamiento compacto de esferas. En este tipo de estructura cada átomo metálico está rodeado por otros doce átomos (seis en el mismo plano, tres por encima y tres por debajo). Además, debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales y tienen la capacidad de moverse libremente a través del compuesto metálico, lo que otorga a éste las propiedades eléctricas y térmicas.
Características:
Las características básicas de los elementos metálicos son producidas por la naturaleza del enlace metálico. Entre ellas destacan:
- Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y sus puntos de fusión y ebullición varían notablemente.
- Las conductividades térmicas y eléctricas son muy elevadas (esto se explica por la enorme movilidad de sus electrones de valencia).
- Presentan brillo metálico, por lo que son menos electronegativos.
- Son dúctiles y maleables (la enorme movilidad de los electrones de valencia hace que los cationes metálicos puedan moverse sin producir una situación distinta, es decir, una rotura).
- Pueden emitir electrones cuando reciben energía en forma de calor.
- Tienden a perder electrones de sus últimas capas cuando reciben cuantos de luz (fotones), fenómeno conocido como efecto fotoeléctrico.
Enlaces iónicos según el modelo de lewis:




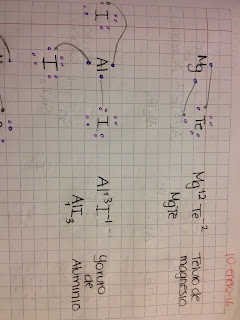




No hay comentarios:
Publicar un comentario